Estimar a qualidade fisiológica de sementes de milho - Antônio Robaina
Tese Doutorado em Agronomia - Apresentada em 1998 - Antônio Dias Robaina
AVALIAÇÃO DE ELETROFOTOGRAFIAS COMO MÉTODO DE ESTIMAR A QUALIDADE FISIOLÓGICA DE SEMENTES DE MILHO (Zea mays L.)
TESE APRESENTADA À FACULDADE DE AGRONOMIA ELISEU MACIEL, UNIVERSIDADE FEDERAL DE PELOTAS, SOB ORIENTAÇÃO DO PROF. SILMAR TEICHERT PESKE, PARA A OBTENÇÃO DO TÍTULO DE DOUTOR EM AGRONOMIA, NA ÁREA DE CONHECIMENTO EM CIÊNCIA E TECNOLOGIA DE SEMENTES - 1998
AUTOR: DOUTOR ANTÔNIO DIAS ROBAINA
SINOPSE: Foi relatado no livro "Experiências Psíquicas Além da Cortina de Ferro", de Sheila Ostrander e Lynn Schroeder, em 1970, o registro de energias emitidas pelos seres vivos através de fotografias tiradas em ambiente de alta voltagem e frequência. Essas eletrofotografias conseguem captar radiações de energia que os organismos vivos possuem, e portanto, podem ser passível de estudos e interpretações quanto ao estado energético e possível desempenho futuro do organismo eletrofotografado. Sendo as sementes organismos vivos, observações preliminares mostraram que diferentes condições das sementes levavam a uma resposta fotográfica diferente. Portanto pretendeu-se com este trabalho de pesquisa, investigar a possibilidade de separar sementes mortas, das vivas, examinando e quantificando o fenômeno que ocorre através das cores dos halos energéticos. Na primeira fase procurou-se nas eletrofotografias apenas diferenças visuais entre sementes vivas e vigorosas, das mortas por temperatura, que tivessem repetibilidade para as mesmas condições. Na segunda fase procurou-se diferenças entre sementes vivas e vigorosas e sementes mortas por senescência. Na terceira fase procuro-se fazer medições na composiçao das cores, em lugares predefinidos, baseado na observação das fotografias como possíveis diferenciadores de acordo com a condição de morta ou viva das sementes. Na quarta fase foi feita uma avaliação do potencial das eletrofotografias como estimadoras do potencial do potencial de germinação dos lotes de sementes, comparando-se os resultados do teste padrão de germinação com os da eletrofotografia em quinze lotes de sementes de milho. Os resultados obtidos permitiram as seguintes conclusões: a) as eletrofotografias possuem um alto potencial como método de estimar o poder germinativo dos lotes de sementes de milho, e a variável G, componente verde das emissões, mostrou-se o melhor parâmetro para estimar o poder germinativo dos lotes; b) o módulo fotográfico da máquina kirlian pode ser adaptado para uso com sementes. Termos para indexação: Eletrofotografia, eletrografia, fotografia kirlian, semente de milho.
Em experiências pioneiras com eletrofotografias em sementes, o autor desta tese percebeu em resultados preliminares, sem uma análise mais aprofundada, que diferentes condições das sementes levavam a uma resposta fotográfica diferente. Portanto pretendeu-se com este trabalho de pesquisa, investigar a possibilidade de separar sementes mortas, das vivas, examinando o fenômeno que ocorre através das cores dos halos energéticos e, se possível, desenvolver uma nova metodologia de avaliação da qualidade fisiológica das sementes através de eletrofotografias.
MATERIAL E MÉTODOS
Local e período de Trabalho: O presente trabalho foi conduzido, no Laboratório Didático de Análise de sementes da FAEM/UFPEL, em uma sala especial para computação e digitalização de dados, montada no Departamento de Fitotecnia da FAEM, e as revelações das fotografias obtidas feitas na loja comercial José Edson Nobre (Treko's) de Pelotas/RS, no período de março de 1996 a setembro de 1997.
Sementes utilizadas: Foram utilizadas sementes de milho sem tratamento químico, dos híbridos Pioneer 3335, 3069, 3099, produzidas pela Pionner, unidade de Santa Cruz/RS e dos híbridos produzidos pela EMBRAPA BR201, BR3123, provenientes de várias localidades do Estado do Mato Grosso do Sul.
Determinações iniciais: Logo após o recebimento das sementes, estas foram avaliadas quanto ao grau de umidade, germinação e submetidas aos testes de envelhecimento precoce e teste de frio.
Seleção das sementes para o trabalho: As diferentes percentagens de germinação e de vigor dos lotes foram detectados de acordo com o teste de germinação, e principalmente, pelo teste de frio respectivamente, e a seguir, classificados em lotes de alto, médio e baixo vigor. Também foram usadas sementes sabidamente mortas por senescência (por estarem por muito tempo armazenadas e o teste de germinação dar zero como resposta), e sementes mortas por alta temperatura em uma câmara a 105graus célsius por 24 horas.
Nesta pesquisa foi considerado de alto, médio e baixo vigor, os lotes que apresentavam o teste de frio acima de 90%, entre 65% e 75%, e abaixo de 50% respectivamente. O teste de envelhecimento precoce por ter uma ação muito drástica sobre as sementes serviu apenas para uma confirmação na qualidade dos lotes. Os lotes só entravam para a pesquisa se estivessem com o grau de umidade entre 11 e 13%.
Para se ter sementes mais achatadas, e com consequente maior superficie de contato das sementes com o fime, todas as sementes fotografadas nesta pesquisa foram classificadas por largura em uma peneira de furos redondos com 8,5 mm de diâmetro.
Equipamentos e materiais para fotografias e avaliações computacionais:
a) Máquina Kirlian Modelo 6SL-1 (Padrão Newton Milhomens)
Voltagem de saída = 6,5 KV
Tempo de exposição = 4 segundos
Frequência de 140 KHz (onda quadrada)
b) Computador Pentium 166 MHz RAM = 32 MB
c) Scanner HP Scan Jet IIcx
d) Impressora HP Desk Jet 850C
e) Filmes coloridos Fujicollor 100 ASA
f) Sistema Operacional - Windows 95
g) Sofware de digitalização - Desk Scan II v.2.1
h) Sofware de avaliação de cores - Corel Photo - Paint 6.0
i) Sofware estatístico - SAEG 5.0
j) Software para cálculos - EXECEL 97
k) Sofware para texto - Word 97
PROCURA DAS DIFERENÇAS ENTRE SEMENTES VIVAS E MORTAS PELA ELETROFOTOGRAFIA
ETAPA 1: Para a busca de algumas características iniciais que diferenciassem as sementes vivas das mortas, foram fotografadas 80 sementes de uma amostra de um lote de alto vigor, e 80 sementes de uma amostra de sementes mortas por alta temperatura. Após as sementes serem fotografadas, eram numeradas e levadas a um germinador para a confirmação de vida ou morte e comparação com a fotografia correspondente. Nesta fase procurou-se apenas diferenças visuais nas fotografias que tivessem repetibilidade para as mesmas condições. Este procedimento foi repetido por três vezes, com um total de 480 fotografias e permitindo tirar os padrões fotográficos iniciais.
ETAPA 2: Nesta etapa, procurou-se diferenças entre sementes vivas e vigorosas e sementes mortas por senescência, usando-se a mesma metodologia da etapa 1, o que permitiu separar os padrões fotográficos de sementes mortas por senescência.
ETAPA 3: Nesta etapa, procurou-se fazer medições na composição das cores, em lugares pré-definidos, baseado na observação das fotografias como possíveis diferenciadores de acordo com a condição de morta ou viva das sementes.
Foram formados três grupos de sementes que vieram a compor o grupo das sementes mortas por temperatura, das sementes mortas por senescência e das sementes vivas.
Escolheu-se realizar as medições dos componentes R (vermelho), G (verde), B (azul), e RGB (R+G+B), das cores das emissões dos dois lados internos do 1/4 superior da região embrionária, logo abaixo da curvatura do endosperma córneo (seta verde. figura 4), ou diretamente nas emissões laterais internas, uma de cada lado (seta verde, figura 5), quando estas estão bem definidas e acompanhadas de emissões da coroa também bem definidas e retas, somar esses valores e dividir por dois para obter o local 1, e na metade de qualquer um dos três raios centrais das emissões energéticas da parte superior da coroa da semente para obter o local 2 (seta vermelha, figuras 4 e 5). Posteriormente, realizou-se testes estatísticos para averiguação da existência, ou não de diferenças significativas.
Para isto foram fotografadas 390 sementes, sendo 130 sementes mortas por temperatura, 130 sementes mortas por senescência, e 130 sementes vivas e vigorosas, fotografando-se 13 sementes de cada grupo por filme, num total de 10 filmes. Após a tomada de fotografia, cada semente era numerada e levada ao germinador para a confirmação da condição da semente de cada grupo em cada filme. Após a resposta do germinador, eram selecionadas apenas 30 fotografias de sementes por filme, sendo 10 de cada grupo, totalizando 300 sementes nos 10 filmes, e que fizeram parte da análise, tendo-se assim a certeza de que nenhum grupo teria componentes de outro.
Logo após a obtenção dos 10 filmes, estes eram revelados e passados para o computador através do scaner, ajustado para ler cores de 24 bits, e com uma resolução de 150 dpi, e as fotografias dos diferentes grupos avaliadas nos locais já descritos acima, através da ferramenta conta-gotas do Corel Photo-Paint, ajustada para avaliar um quadrado de 25 pixels. Os dados obtidos foram passados para tabelas para posterior análise estatística.
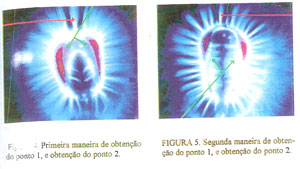
Figura 4. Primeira maneira de obtenção do ponto 1, e obtenção do ponto 2
Figura 5. Segunda maneira de obtenção do ponto 1, e obtenção do ponto 2
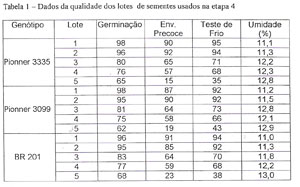
ETAPA 4: Para se avaliar o potencial das eletrofotografias como estimadoras do potencial de germinação dos lotes de sementes, com as técnicas apuradas nesta pesquisa, foram selecionadas amostras médias de quinze lotes de sementes, formando três grupos de cinco, e cada grupo pertencente a um genótipo diferente, contendo dois lotes de alto vigor, dois de médio vigor e um de baixo vigor (TABELA 1).
De cada amostra média, de cada lote foram retiradas subamostras de cinquenta sementes, eletrofotografadas, e o potencial de germinação de cada lote foi obtido com o número de sementes interpretadas como vivas, multiplicado por dois. Paralelamente foi feito um teste de germinação padrão para cada lote, com exceção feita ao número de sementes usadas, que foi de duzentas, para servir de comparação com os resultados obtidos com as eletrofotografias.
Tabela 1 - Dados da qualidade dos lotes de sementes usados na etapa 4:
PROCEDIMENTOS ESTATÍSTICOS:
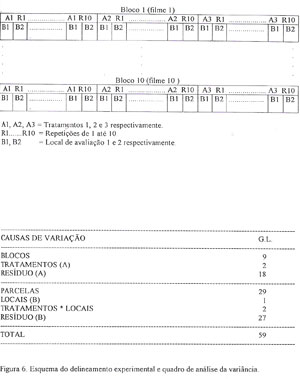
Na etapa 3, foi utilizado um fatorial num delineamento experimental em blocos (filmes) ao acaso com dez repetições internas e com parcelas subdivididas. A condição da semente (morta por temperatura, morta por senescência ou viva) constitui os tratamentos 1, 2 e 3, e foram designado como fator A, e os locais de medição 1 e 2 como fator B. Os tratamentos foram colocados em parcelas e os locais de medição em subparcelas (figura 6).
Para a etapa 4, foi utilizada uma análise de regressão entre as percentagens de germinação estimadas pelas eletrofotografias e as avaliadas pelo teste padrão de germinação. Os dados foram processados através do programa SAEG 5.0 (Sistema para Análise Estatísticas e Genéticas).
RESULTADOS E DISCUSSÃO
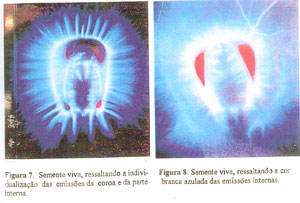
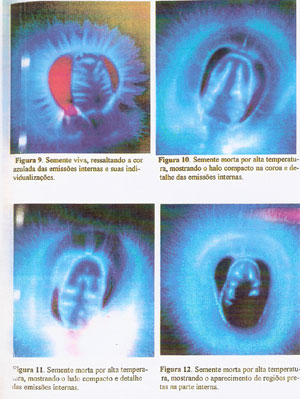
ETAPA 1: Como resultado da análise visual das 480 fotografias tiradas nesta etapa, surgiram alguns padrões que se repetiam tanto nas sementes vivas como nas sementes mortas por altas temperaturas. As sementes vivas se caracterizaram por apresentarem as emissões da coroa bem individualizadas, retas, com algum componente branco na base das emissões e as emissões internas brancas, podendo ser um pouco azuladas, bem delineadas, em forma de estrias ou dentes, que saem perpendicular em relação as partes laterais internas do endosperma córneo, podendo ou não ir até a parte superior curva do mesmo endosperma, mas que cobrem pelo menso três quartos (3/4) da parte interna da semente (Figuras 7 à 9).
As sementes mortas por altas temperaturas se caracterizam por não possuírem as emissões da coroa delineadas, formando um halo compacto em volta das sementes, com um tom azul escuro tanto externo como internamente, e as emissões internas não delineadas ou com muito poucas, quase sempre não partindo das laterais internas do endosperma córneo, e muitas vezes apresentando regiões pretas internamente (Figuras 10 à 12).
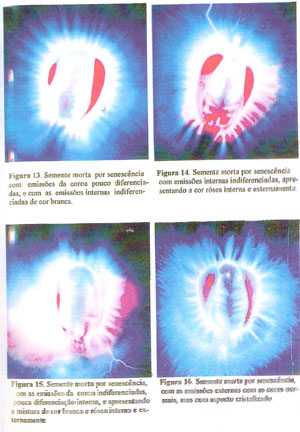
ETAPA 2: Ao examinar sementes mortas por senescência, e comparar com as sementes vivas, observou-se que aquelas apresentavam-se diferentes das sementes mortas por altas temperaturas, apresentando alguns aspectos peculiares e que muitas vezes pode causar confusão com a eletrofotografia de uma semente viva. As sementes mortas por senescência podem apresentar-se em dois padrões principais, sendo que no primeiro, elas podem possuir a zona da coroa com emissões pouco diferenciadas ou não diferenciadas, apresentando as cores brancas ou verde normais e as vezes acompanhadas da cor rósea, mas com as emissões internas indiferenciadas, formando uma massa branca, rósea, azulada ou mistura destas cores (Figuras 13 à 15).
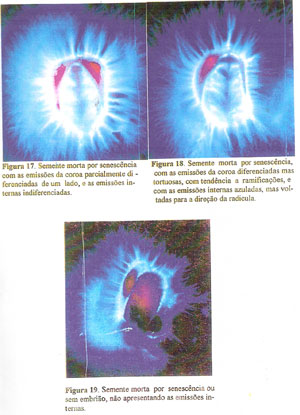
No segundo padrão, apresentam as emissões da coroa diferenciadas no todo ou parcialmente, mas não retas, apresentando-se tortuosas ou ramificadas, muitas vezes, tendo aspecto de cristais, acompanhadas de emissões internas não diferenciadas e, quando diferenciadas, apresentam-se com a cor azulada mas dirigidas para a região da radícula. Às vezes, as sementes podem se apresentar sem nenhuma emissão interna (Figuras 16 à 19).
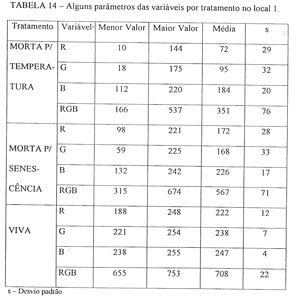
ETAPA 3 VARIÁVEL R (VERMELHO): A análise da variância para a variável R, acusa que esta variável comporta-se de modo estatisticamente diferente entre os tratamentos e entre os locais, e que os tratamentos dependem dos locais devido à interação entre estes fatores ser significante (Tabela 1, Anexo). Observando-se a comparação entre as médias de tratamentos (TABELA 2), verifica-se que a média desta variável é, significativamente, diferente para os três tratamentos e, que as sementes mortas por temperatura, produzem emissões com valores reduzido do componente R. Apenas 48% dos valores das médias alcançadas pelas sementes mortas por senescência, o que pode ser um meio de se identificar danos por altas temperaturas nas sementes. Nas eletrofotos, a pequena quantidade de R, em relação a G e B, produz uma tonalidade azul escuro.

Quando se examina o comportamento dos tratamentos dentro de cada local, conclui-se que somente o local 1 (TABELA 3), pode ser usado para separar os diferentes tratamentos, pois o local 2 (TABELA 4), não consegue separar as sementes vivas (tratamento 3), das sementes mortas por senescência (tratamento 2).
Examinando-se a TABELA 3, verifica-se que realmente existe uma baixa emissão de R nas sementes mortas por temperatura, onde pode-se ver que este componente atinge apenas 32% dos valores das médias alcançadas pelas sementes mortas por senescência. Existe também uma ampla margem de valores entre as sementes vivas e as mortas por senescência, onde se observa que estas possuem suas médias com valores igual a 77% dos valores alcançados pelas sementes vivas. Estas diferenças de valores leva a uma possibilidade de separação entre as diferentes condições das sementes.


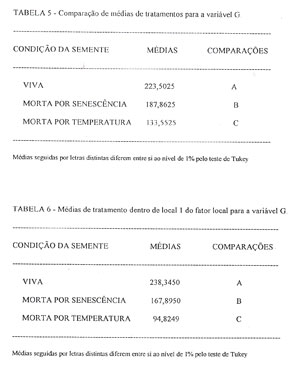
VARIÁVEL G (VERDE): A análise da variância par a variável G, acusa que esta variável se comporta de modo semelhante à variável R, sendo estatisticamente diferente entre os tratamentos e entre os locais, e que os tratamentos também dependem dos locais, devido à interação entre estes fatores, ser significante (Tabela 2, Anexo). Ao observar-se a comparação entre as médias de tratamentos (TABELA 5), verifica-se que a média desta variável é significativamente diferente para os três tratamentos.
Pela análise da TABELA 6, verifica-se que a variável G alcança uma média de valores no tratamento das sementes mortas por temperatura correspondente a 56% dos valores alcançados pelas sementes mortas por senescência, e estas, 84% dos valores das médias das sementes vivas, o que permitiria dentro de uma determinada faixa de valores usá-la como separador dos tratamentos. Também, neste caso só pode-se usar a variável G como separador dos tratamentos, no caso de se usar o local 1 (TABELA 6), pois o local 2 (TABELA 7), também não permite separar as sementes vivas (tratamento 3), das sementes mortas por senescência (tratamento 2).

VARIÁVEL B (AZUL) : O quadro de análise da variância da variável B (Tabela 3, Anexo), mostra que esta variável apresenta diferenças significantes para tratamentos e para a interação. Pode-se observar pela TABELA 8, que há diferença entre todos os tratamentos, o que credenciaria em princípio também esta variável como separadora de tratamentos.
No entanto, uma análise da TABELA 9, mostra que existe uma diminuição na diferença das médias dos vários tratamentos e que estas são mais altas em relação as variáveis R e G já analisadas. Vê-se que as médias das sementes mortas por temperatura alcançam 81% dos valores das médias das mortas por senescência, e estas 91% dos valores das sementes vivas, o que em princípio diminui as margens de separação. Neste caso, também, esta variável só serviria para separar tratamentos dentro do local 1 (TABELA 9), pois o local 2 também não diferencia as sementes vivas das mortas por senescência (TABELA 10).


VARIÁVEL RGB (VERMELHO + VERDE + AZUL) : Pela análise de sua tabela de variância (Tabela 4, Anexo), esta variável apresenta comportamento semelhante à variável B. Podemos observar pela TABELA 11, que há diferença entre todos os tratamentos, o que credenciaria em princípio, também esta variável como separadora dos tratamentos.
Observando-se o comportamento desta variável, TABELA 12, vê-se que o potencial de separação se mantém, pois existe uma razoável faixa de diferença nas médias dos tratamentos, sendo uma diferença d 28% entre os valores das médias das sementes mortas por temperatura e por senescência, e de 20% entre estas e as vivas. Neste caso também, está variável só serviria para separar tratamentos dentro do local 1 (TABELA 12), pois o local 2, também não diferencia as sementes vivas das mortas por senescência (TABELA 13).


Pelas discussões anteriores, pode-se observar que todas as variáveis estudadas (R, G, B E RGB), poderiam potencialmente serem usadas como diferenciadoras dos tratamentos, e que o local 2 fica descartado das avaliações por não poder separar as sementes vivas, das mortas por senescência. Portanto resta continuar analisando o comportamento das variáveis nos tratamentos dentro do local 1.
Para se comparar as diferentes variáveis, e escolher a que melhor se comporta em evitar erros de avaliação, foi preparada a Tabela 14, que permitiu analisar os valores assumidos pelas variáveis nos diferentes tratamentos dentro do local 1. Com a observação da TABELA 14, vê-se que o tratamento 3 (sementes vivas), possui os maiores valores para todas as variáveis tanto em relação aos valores máximos como para as médias apresentadas pelas variáveis. Daí então, tomou-se como base para a separação dos tratamentos, a média das variáveis apresentadas pelo tratamento 3.
Continuando a análise da TABELA 14, vê-se que existe uma amplitude de valores abaixo da média no tratamento 3, representados pelos valores menores que a média, estendendo-se até o seu valor mínimo. Uma outra amplitude de valores localizada acima da média dos valores das variáveis dos tratamentos 1 e 2, vão até os seus valores máximos, podendo sobrepor em certa extensão a amplitude abaixo da média do tratamento 3. Para se obter um bom parâmetro diferenciador dos tratamentos, este não deve permitir a referida sobreposição, e, se o fizer, que seja em uma faixa mínima.
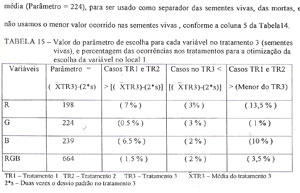
Para buscar esse parâmetro, foi obtido para cada variável, um valor igual a sua média no tratamento 3 (sementes vivas), menos o dobro do respectivo desvio padrão, conforme a TABELA 15. Na mesma tabela, estão os valores correspondentes ao número de ocorrências dos valores das variáveis nos tratamentos 1 (sementes mortas por temperatura), e 2 (sementes mortas por senescência), que foram maiores que o parâmetro utilizado, nos permitindo eliminar as variáveis R e B, devido seus valores serem muito altos, 7% e 6,5% respectivamente.
Continuando com as variáveis G e RGB, por apresentarem valores baixos, 0,5% e 1,5% respectivamente na TABELA 15, passou-se a análise das referidas variáveis na mesma tabela, onde se testou para o número de casos ocorridos dentro do ytratamento 3 que são menores que o parâmetro utilizado.
Nesta análise, tanto G como RGB apresentam valores muito baixos, 3% e 2% respectivamente, não permitindo a eliminação de nenhuma delas. Considerando que a variável G, registrou um erro de avaliação de 0,5% quando foi considerado o número de casos dos tratamentos 1 e 2 que foram maiores que o parâmetro utilizado, mais um erro de 3% quando considerado o número de casos no tratamento 3 que foram menores do que o parâmetro utilizado, teremos um erro total de 3,5%. Se esta análise for feita para a variável RGB, tem-se um erro total também de 3,5%.
Analisando a percentagem de sementes mortas por senescência e temperatura, cujos valores de R,G,B ou RGB apresentaram-se superiores ao mínimo encontrado nas sementes vivas, constatou-se que o parâmetro da variável G apresentou apenas 1% das sementes com sobreposição de valores, enquanto que o parâmetro de RGB apresentou 3,5 (TABELA 15).
Como as percentagens totais de erros de avaliação ocorrem em valores muito pequenos (3,5%), tanto para G como para RGB, escolhemos a variável G como separadoras dos tratamentos apenas pelo fato desta admitir menos sementes mortas como vivas, conforme demonstra a coluna 3 da TABELA 15. Também pelo mesmo motivo, ficamos com o valor obtido pela subtração do dobro do desvio padrão dos valores de G nas sementes vivas de sua média (Parâmetro = 224), para ser usado como separador das sementes vivas, das mortas e não usamos o menor valor ocorrido nas sementes vivas, conforme a coluna 5 da Tabela 14.
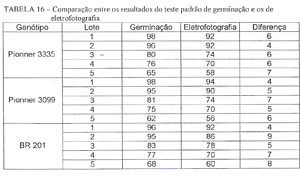
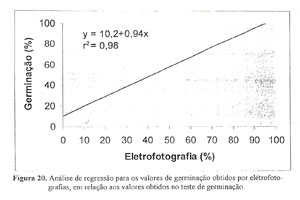
ETAPA 4: Para testar o parâmetro da variável escolhida (G), foi realizada a avaliação do potencial de germinação de quinze lotes de sementes pelo método padrão de germinação e pelo método das eletrofotografias, cujos resultados estão na TABELA 16, e feita uma análise de regressão entre os resultados dos dois métodos (Figura 20).
Pela análise da TABELA 16, percebe-se uma diferença de resultados entre os dois métodos, que pode ser explicada pela existência de uma possível fonte de erro devido à falta de adaptação do módulo fotográfico da máquina usada, e que só será resolvida com o desenvolvimento de um módulo fotográfico adaptado a fotografia de sementes. Foi observado que as partes não aderentes da semente ao filme, pode levar a registros ou omissões de cor diferentes da realidade.
Embora exista diferenças de avaliações entre os dois métodos (TABELA 16), os resultados apresentam estreita relação, r2 = 0,98 (Figura 20), mostrando com isso um alto potencial da eletrofotografia como base de avaliação para determinação do potencial de germinação de um lote de sementes de milho, bastando desenvolver um módulo que consiga fotografar mais sementes de cada vez e com boa aderência.
Outra observação que deve ser feita em relação aos dados da TABELA 16, é que os valores da germinação dos lotes obtidos pelas eletrofotografias são sempre menores do que os obtidos pelo teste padrão de germinação, levando a pressupor que as eletrofotografias possam avaliar. como mortas, as sementes com alto grau de deterioração, embora possam ainda germinar pelo teste padrão de germinação. Sempre há uma dispersão na capacidade de germinação das sementes dentro de um lote. Inclusive, essa dispersão é grande, pois o teste de germinação é realizado sob condições ótimas, possibilitando que sementes em estado avançado de deterioração consigam germinar.
Como foi constatado na revisão bibliográfica, as eletrofotografias conseguem detectar com antecedência os sintomas de enfermidades em plantas. Assim, porque não também o processo de deterioração.
As eletrofotografias possuem potencial para avaliar o poder germinativo dos lotes de sementes tanto por meios quantitativos como qualitativos, com a mesma precisão.
Para uma avaliação qualitativa o analista deverá dominar os vários aspectos das formas e cores das emissões internas e externas, o que é adquirido com certa rapidez e facilidade. No entanto, este processo exigiria o exame de cada foto, em particular, em seus vários aspectos, tornando a análise mais cansativa e dificultando um futuro desenvolvimento de um software de avaliação pela complexidade do exame exigido.
Por meios quantitativos, o software teria que fazer a leitura do valor de uma determinada cor em um determinado local da eletrofotografia e comparar com um valor pré estabelecido, e daí decidir pela avaliação da semente em análise. Observe-se que mesmo em uma análise quantitativa, existe um componente qualitativo a ser decidido pelo analista na hora de examinar uma eletrofotografia, que é a escolha do posicionamento do local de avaliação (local 1).
CONCLUSÕES - De acordo com os resultados obtidos e discutidos, tiramos as seguintes conclusões:
a) As eletrofotografias possuem um alto potencial como método de estimar o poder germinativo dos lotes de sementes de milho;
b) O componente verde das emissões é o recomendável para estimar o poder germinativo dos lotes, tendo como parâmetro de separação entre sementes vivas e mortas, o valor 224;
c) Considerando que o módulo fotográfico da máquina kirlian não foi desenvolvido para fotografar sementes e sim dedos humanos, são necessárias as seguintes modificações:
1 - Cobrir o eletrodo com material isolante maleável para uma acomodação total da face fotografada da semente, quando pressionada pelo terminal do fio terra,
2 - O Terminal do fio terra precisa ter maior superfície de contato com a semente para evitar a fuga lateral da mesma,
3 - Construir um módulo fotográfico que fotografe, no mínimo, 50 sementes por vez para o método não ficar demasiado trabalhoso.



